По интернету гуляют картинки со сравнением цен на лекарства с одним действующим веществом. Почему у одного производителя препарат может стоить в 2 раза дороже, чем у другого?
По словам доктора медицинских наук Светланы Ксеневой, для создания препарата с "нуля" нужно сделать очень много. Всё начинается с поиска подходящих молекул, которые потенциально могут помочь в конкретной проблеме, например, для снятия боли. Затем нужно проверить не только эффективность, но и безопасность этих молекул на животных.

Если молекула проявила свою эффективность и показала безопасность, то начинается фаза клинических исследований, конечно, при наличии разрешения Минздрава.
Сначала проводится небольшое исследование с участием здоровых добровольцев для оценки безопасности, на следующем этапе кандидат в препараты уже будут давать пациентам для оценки его эффективности, и на третьем этапе клинических исследований он будет применяться в нескольких десятках клиник, возможно и в нескольких странах, у пациентов с разными сопутствующими заболеваниями, в комбинациях с другими препаратами.
Только то средство, которое прошло успешно фазу доклинических исследования и все три фазы клинических исследований, может быть зарегистрировано в Минздраве как лекарственный препарат.

На весь процесс может уйти 15 лет, а из 10 тысяч исходных молекул только 250 дойдут до фазы доклинических исследований, 5 – до начала клинических исследований и только один препарат, успешно прошедший все фазы, получит регистрационное удостоверение и появится в аптеках.
Такой препарат будет называться "оригинальным", и только та фирма, которая вывела этот препарат на рынок, будет его выпускать и продавать.
Но через несколько лет секрет состава препарата обязан быть раскрыт и любой фармацевтический завод может попробовать синтезировать копию этого препарата.
Но даже доказав в Минздраве, что копия идентична оригиналу, для вывода на фармацевтический рынок придется провести одно клиническое исследование – исследование биоэквивалентности.
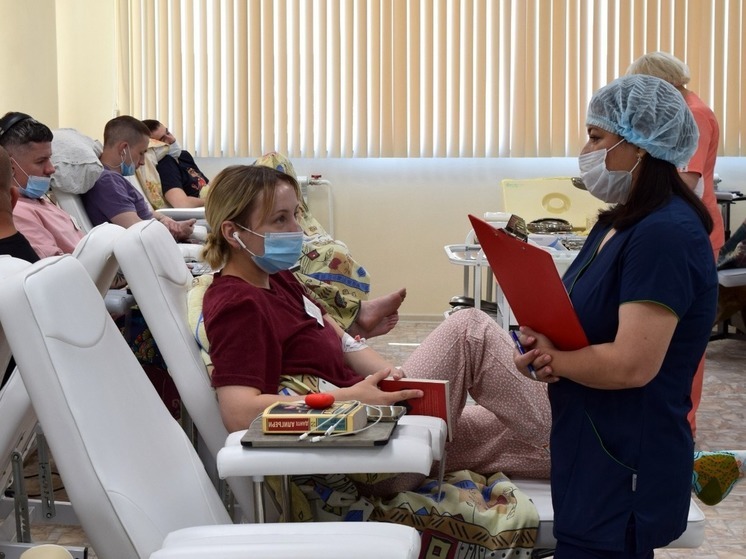
Здоровые добровольцы примут одну таблетку оригинального препарата и через неделю одну таблетку копии препарата (он называется "дженерик"). По определенному графику у добровольцев в каждый период будет отбираться кровь для определения концентрации действующего вещества в крови. И если у каждого добровольца эти графики совпадут – такой дженерик может уже через год появиться в аптеках.
Кстати, добровольцы в этих исследованиях участвуют на возмездной основе и могут получить за одно участие от 10 до 50 тысяч руб. Естественно, цена создания оригинала и дженерика несопоставима, что в конечном счёте и сказывается на цене препарата.
Такие исследования для регистрации дженериков проводятся и в Томске – в клинике НИИ Фармакологии и регенеративной медицины им. Е.Д. Гольдберга только в 2024 году их было проведено 20. Это были препараты для лечения сахарного диабета, артериальной гипертензии и гастрита – перечень заболеваний очень большой.